Tổng quan về bộ môi trường nuôi cấy tế bào NK:
Biệt hóa tế bào CD34+ được phân lập từ máu cuống rốn (CB) và tủy xương (BM) thành tế bào giết tự nhiên (NK)—mà không cần sử dụng huyết thanh hoặc tế bào gốc—bằng cách sử dụng Bộ môi trường nuôi cấy tế bào StemSpan™ NK Cell Generation. Bộ sản phẩm này thúc đẩy sự phát triển của hàng nghìn tế bào NK CD56+ trong các nuôi cấy được khởi tạo bằng tế bào CB người CD34+.
StemSpan™ Lymphoid Progenitor Expansion Supplement (10X) chứa hỗn hợp cytokine người tái tổ hợp và các chất phụ gia khác được bào chế để thúc đẩy chọn lọc sự phát triển và biệt hóa của các tế bào CD34+ được phân lập từ mẫu CB và BM người thành tế bào tiền thân lymphoid khi sử dụng kết hợp với môi trường StemSpan™ SFEM II và trên bề mặt nuôi cấy có được phủ bởi StemSpan™ Lymphoid Differentiation Coating Material (100X). Sau đó, StemSpan™ NK Cell Differentiation Supplement (100X) được sử dụng kết hợp StemSpan™ SFEM II và UM729 (catalog #72332) cho phép biệt hóa các tế bào tiền thân dòng tủy thành tế bào NK.
Để thuận tiện linh hoạt trong nghiên cứu, tất cả các thành phần của bộ sản phẩm cũng có sẵn riêng lẻ.
Ứng dụng: Nuôi cấy tế bào, Biệt hóa, Tăng sinh
Thành phần bộ kit:
- StemSpan™ NK Cell Generation Kit (Catalog #09960), bao gồm:
- StemSpan™ SFEM II (Catalog #09605), 100 mL
- StemSpan™ Lymphoid Progenitor Expansion Supplement (10X) (Catalog #09915), 5 mL
- StemSpan™ Lymphoid Differentiation Coating Material (100X) (Catalog #09925), 250 µL
- StemSpan™ NK Cell Differentiation Supplement (100X) (Catalog #09950), 500 µL
Dữ liệu:
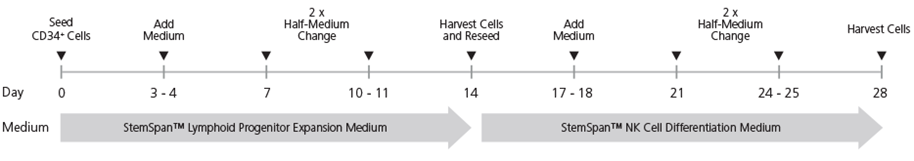
Hình 1. Quy trình nuôi cấy tế bào NK bằng StemSpan™ NK Cell Generation
Tế bào CD34+ có nguồn gốc từ CB được cấy vào ngày 0. Môi trường nên được bổ sung sau 3 - 4 ngày nuôi cấy, sau đó thay đổi một nửa môi trường hai lần sau mỗi 3 - 4 ngày. Vào ngày 14, các tế bào ở giai đoạn tiền thân lymphoid được thu hoạch và cấy lại để biệt hóa thành tế bào NK. Việc bổ sung và thay đổi một nửa môi trường nên được thực hiện sau mỗi 3 - 4 ngày sau khi thu hoạch và cấy lại, như được chỉ ra trong hình. Lưu ý: Chỉ nên thêm UM729 vào Môi trường biệt hóa tế bào NK (NK Cell Differentiation Medium), nhưng không phải Môi trường tăng sinh tiền thân lymphoid (Lymphoid Progenitor Expansion Medium).
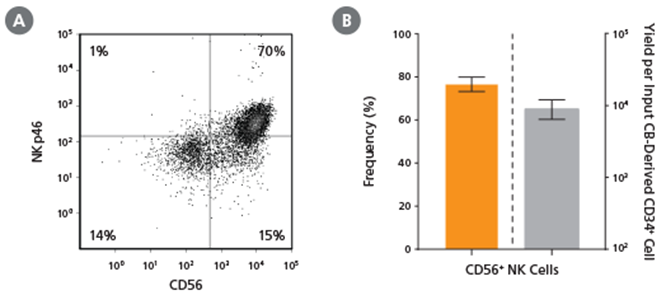
Hình 2. Tần suất và năng suất tế bào NK CD56+ sau 28 ngày nuôi cấy
Tế bào CD34+ có nguồn gốc từ CB (mới phân lập hoặc đông lạnh) được nuôi cấy bằng StemSpan™ NK Cell Generation Kit trong 28 ngày như đã mô tả. Các tế bào được thu hoạch và phân tích biểu hiện (A, B) CD56 và (A) NKp46 bằng phương pháp đo tế bào dòng chảy. Các tế bào chết được loại trừ bằng phương pháp phân tán ánh sáng và nhuộm màu khả năng sống. (B) Tần suất trung bình của các tế bào NK CD56+ khả thi vào ngày 28 là 77%, với ~9.000 tế bào CD56+ được sản xuất trên mỗi tế bào CD34+ đầu vào có nguồn gốc từ CB. Hiển thị các giá trị trung bình với khoảng tin cậy 95% (n = 45: 23 mẫu tế bào CD34+ mới phân lập và 22 mẫu tế bào CD34+ đông lạnh). Các tế bào CD34+ có nguồn gốc từ BM cũng được biệt hóa thành tế bào NK bằng StemSpan™ NK Cell Generation Kit. Năng suất tế bào NK từ HSPC BM thường thấp hơn so với CB, trung bình ~75 trên mỗi tế bào CD34+ đầu vào (n = 3, dữ liệu không được hiển thị).
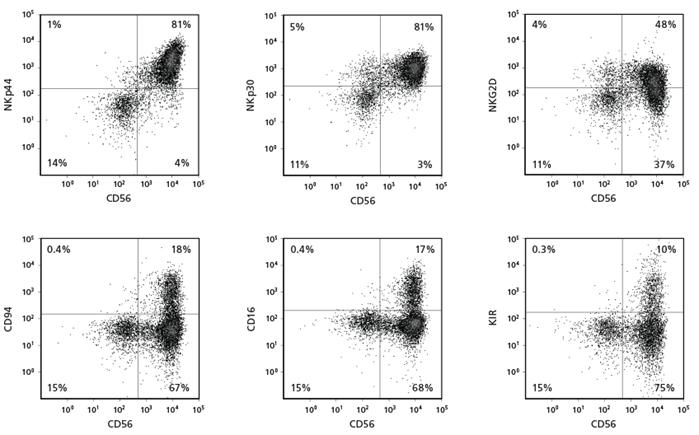
Hình 3. Biểu hiện dấu hiệu bề mặt tế bào trên tế bào NK CD56+ sau 28 ngày nuôi cấy
Tế bào CD34+ có nguồn gốc từ CB được nuôi cấy bằng StemSpan™ NK Cell Generation Kit trong 28 ngày. Các tế bào biệt hóa được thu hoạch và phân tích bằng phương pháp đo tế bào dòng chảy để biểu hiện CD56, NKp44, NKp30, NKG2D, CD94, CD16 và KIR. Nhuộm phân tử KIR được thực hiện bằng cách kết hợp hai dòng kháng thể, 180704 và HP-MA4, vì mỗi dòng nhận diện một tập hợp con riêng biệt của các phân tử KIR.

Hình 4. Tế bào NK nuôi cấy thể hiện độc tính đối với dòng tế bào K562
Tế bào NK được tạo ra từ tế bào CD34+ có nguồn gốc từ CB trong 28 ngày bằng cách sử dụng quy trình trong Hình 1. Vào ngày 28, các tế bào được thu hoạch, nhuộm CD56 và đếm số tế bào CD56+ sống. Tế bào K562 được ủ với 8 μM calcein AM ở 37°C trong 1 giờ và sau đó rửa hai lần. Sau đó, tế bào NK CD56+ được kết hợp với 10.000 tế bào đích K562 được gắn nhãn calcein AM này theo tỷ lệ Tác nhân:Mục tiêu là 5:1 trong các đĩa 96 giếng đáy chữ U và đồng nuôi cấy ở 37°C trong 4 giờ. Tế bào NK máu ngoại vi (PB) trưởng thành và các tế bào đơn nhân được phân lập bằng EasySep™ được sử dụng làm đối chứng dương và đối chứng âm tương ứng. Tế bào NK PB được nuôi cấy qua đêm với Chất bổ sung biệt hóa tế bào NK (NK Cell Differentiation Supplement) và SFEM II, trong khi tế bào đơn nhân PB chỉ được nuôi cấy qua đêm trong SFEM II. Để phát hiện sự giải phóng tự phát, các giếng đối chứng chỉ chứa các tế bào đích K562 được gắn nhãn calcein AM đã được thiết lập. Các tế bào K562 được gắn nhãn được xử lý bằng 1% Triton™ X-100 để đo mức giải phóng tối đa. Sau khi ủ, các đĩa được ly tâm ở tốc độ 500 x g trong 5 phút và 100 μL dịch nổi được chuyển vào các đĩa đen và phân tích bằng máy đọc vi đĩa SpectraMax® (kích thích 485 nm/phát xạ 530 nm). Kết quả được biểu thị dưới dạng % ly giải đặc hiệu: [(giải phóng thử nghiệm - giải phóng tự phát) x 100] / (giải phóng tối đa - giải phóng tự phát). Các tế bào NK có nguồn gốc từ CB CD34+ cho thấy hoạt động tiêu diệt tương tự đối với các tế bào đích K562 so với các tế bào NK PB. Hiển thị là giá trị trung bình ± SD (các tế bào NK có nguồn gốc từ CB CD34+: n = 18, các tế bào NK PB và các tế bào đơn nhân: n = 7).