

Tế bào giết tự nhiên (NK) là tế bào miễn dịch bẩm sinh có khả năng tiêu diệt các tế bào bị nhiễm khối u hoặc vi-rút cũng như tiết ra các cytokine gây viêm. Tế bào NK của người có nguồn gốc từ tế bào gốc tạo máu CD34+ và tế bào tiền thân (HSPC) trong máu dây rốn (CB) và tủy xương (BM). Nuôi cấy trong ống nghiệm để thúc đẩy sự biệt hóa của tế bào CD34+ HSPC thành tế bào NK là một công cụ hữu ích cho nghiên cứu về việc sử dụng tế bào NK cho liệu pháp miễn dịch nuôi cấy cũng như nghiên cứu về sinh học tế bào NK cơ bản.
StemSpan™ NK Cell Generation Kit là môi trường nuôi cấy serum free, feeder-free giúp biệt hóa tế bào CD34+ được phân lập từ máu dây rốn hoặc tủy xương thành tế bào NK. Tham khảo phần 4 để biết quy trình biệt hóa.
StemSpan™ NK Cell Generation Kit có thể được sử dụng với tế bào CD34+ tươi hoặc đông lạnh thu được từ CB hoặc BM, hoặc có nguồn gốc từ hPSC. Trong bộ kit này, tế bào CD34+ đầu tiên được biệt hóa thành tế bào tiền thân lymphoid CD7+CD5+, sau đó được định hướng biệt hóa thành tế bào NK CD56+.
StemSpan™ NK Cell Generation Kit (#09960)
| Sản phẩm | Quy cách | Mã sản phẩm |
| StemSpan™ Lymphoid Progenitor Expansion Supplement (10X) | 5 mL | |
| StemSpan™ Lymphoid Differentiation Coating Material (100X) | 250 µL | |
| StemSpan™ NK Cell Differentiation Supplement (100X) | 0.5 mL | |
| StemSpan™ SFEM II | 100 mL |
Sản phẩm | Mã sản phẩm |
| D-PBS (Without Ca++ and Mg++) | |
| Trypan Blue | |
| UM729 | |
| Non-tissue culture-treated cultureware | 21024010 (24 wells) |
Quy trình sau đây dùng để biệt hóa tế bào CD34+ có nguồn gốc từ hPSC, cũng như tế bào CD34+ được phân lập từ máu dây rốn (CB) hoặc tủy xương (BM) với tế bào NK.
4.1 Sơ đồ quy trình
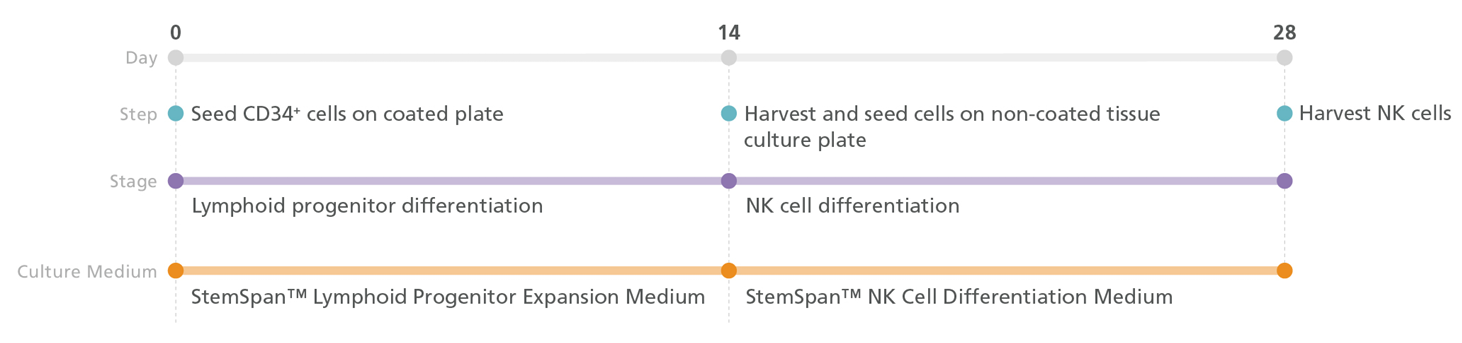
Hình 1. Quy trình biệt hóa tế bào NK sử dụng StemSpan™ NK Cell Generation Kit
4.2 Quy trình biệt hóa
Các hướng dẫn sau đây dành cho một giếng của đĩa 24 giếng. Nếu sử dụng vật nuôi cấy khác, hãy tham khảo Bảng 1 và điều chỉnh số lượng tế bào và thể tích cho phù hợp.
Để đạt hiệu suất tối ưu, hãy tuân theo lịch trình nuôi cấy và cấy chuyền được khuyến nghị. Tuy nhiên, lịch trình có thể được điều chỉnh khi cần thiết, miễn là duy trì khoảng cách nuôi cấy từ 3 - 4 ngày.
Ngày 0
1. Thêm 500 µL StemSpan™ Lymphoid Differentiation Coating Material vào mỗi giếng của đĩa 24 giếng không xử lý bề mặt (#21024010). Nếu sử dụng vật liệu nuôi cấy khác, hãy tham khảo Bảng 1 để biết thể tích cần thiết.
Bảng 1. Thể tích Coating Material và môi trường được khuyến nghị và số lượng tế bào được khuyến nghị cho nhiều loại vật liệu nuôi cấy khác nhau
Đĩa nuôi cấy không xử lý bề mặt | Thể tích Coating Material | Thể tích môi trường tăng sinh hoặc môi trường biệt hóa | Số lượng tế bào CD 34+/giếng | ||
Tế bào có nguồn gốc từ CB | Tế bào có nguồn gốc từ BM | Tế bào có nguồn gốc từ hPSC* | |||
Đĩa 96 giếng (#21096010) | 100 µL/giếng | 100 µL/giếng | 1 x 103
| 5 x 103
| 5 x 103
|
Đĩa 12 giếng (#21012010) | 1 mL/giếng | 1 mL/giếng | 1 x 104
| 5 x 104
| 5 x 104
|
Đĩa 6 giếng (#21006010) | 2.5 mL/giếng | 2.5 mL/giếng | 2.5 x 104
| 1.25 x 105
| 1.25 x 105
|
* Tế bào CD34+ có nguồn gốc từ hPSC được tạo ra bằng STEMdiff™ NK Cell Kit (#100-0170)
2. Ủ ở nhiệt độ phòng (15 - 25°C) trong 2 giờ.
Lưu ý: Hoặc ủ ở nhiệt độ 2 - 8°C qua đêm.
3. Hút Coating Material từ đĩa 24 giếng. Rửa sạch giếng bằng D-PBS (Không có Ca++ và Mg++). Hút D-PBS ngay trước khi sử dụng.
4. Chuẩn bị tế bào CD34+ như sau:
· Nếu sử dụng tế bào CD34+ có nguồn gốc từ hPSC tươi, hãy tiến hành bước 5.
· Nếu sử dụng tế bào CD34+ đông lạnh từ CB hoặc BM của người, hãy rã đông tế bào rồi tiến hành bước 5.
· Nếu sử dụng CB hoặc BM của người tươi (dưới 72 giờ), hãy phân lập tế bào CD34+ bằng một trong các bộ dụng cụ EasySep ™ được liệt kê bên dưới, sau đó tiến hành bước 5.
o CB: EasySep™ Human Cord Blood CD34 Positive Selection Kit II (#17896)
o BM: EasySep™ Human CD34 Positive Selection Kit II (#17856)
5. Thực hiện đếm tế bào sống bằng Trypan Blue và buồng đếm hồng cầu. Xác định % tế bào CD34+ bằng phương pháp flow cytometry, sử dụng một trong các kháng thể liên hợp với fluorochrome sau:
· Anti-Human CD34 Antibody, Clone 581 (#60013)
· Anti-Human CD34 Antibody, Clone 8G12 (#60121)
Để xác định nồng độ tế bào CD34+, nhân % tế bào CD34+ với số lượng tế bào sống.
Lưu ý: Tỷ lệ tế bào CD34+ dự kiến là > 50%.
Nếu tần suất tế bào CD34+ có nguồn gốc từ hPSC sau khi tách tế bào < 50%, việc tách thêm bằng nam châm có thể cải thiện kết quả.
6. Thêm tế bào CD34+ (từ bước 4) vào 500 µL StemSpan™ Lymphoid Progenitor Expansion Medium như sau:
· Tế bào có nguồn gốc từ CB: 1 x 104 tế bào CD34+/mL (5 x 103 tế bào CD34+/giếng)
· Tế bào có nguồn gốc từ BM hoặc hPSC: 5 x 104 tế bào CD34+/mL (2.5 x 104 tế bào CD34+/giếng)
Lưu ý: Dung dịch huyền phù tế bào này dành cho một giếng của đĩa 24 giếng. Nếu sử dụng vật nuôi cấy khác, hãy tham khảo Bảng 1 để biết thể tích và số lượng tế bào cần thiết.
7. Thêm 500 µL dung dịch huyền phù tế bào (đã chuẩn bị ở bước 6) vào một giếng đã phủ của đĩa 24 giếng đã chuẩn bị ở bước 1 - 3. Ủ ở 37°C và 5% CO2 trong 3 hoặc 4 ngày.
Ngày 3 hoặc 4
8. Thêm từ từ 500 µL StemSpan™ Lymphoid Progenitor Expansion Medium vào mỗi giếng của đĩa 24 giếng. Ủ ở 37°C và 5% CO2 trong 3 hoặc 4 ngày.
Lưu ý: Nếu sử dụng tế bào CD34+ có nguồn gốc từ hPSC, hãy theo dõi quá trình nuôi cấy để phát triển các tế bào bám dính. Nếu các tế bào bám dính dường như đạt đến > 50% hợp lưu, nên thực hiện bước 9b: “Đối với tế bào CD34+ có nguồn gốc từ hPSC” sớm để duy trì hiệu suất tối ưu.
Ngày 7
9. Thực hiện thay một nửa môi trường như sau:
a. Cẩn thận hút 500 µL môi trường ra khỏi giếng. Không làm xáo trộn tế bào.
b. Thêm 500 µL StemSpan™ Lymphoid Progenitor Expansion Medium vào mỗi giếng.
· Đối với tế bào CD34+ có nguồn gốc từ CB hoặc BM của con người: Ủ ở 37°C trong 3 hoặc 4 ngày, sau đó tiến hành bước 10.
· Đối với tế bào CD34+ có nguồn gốc từ hPSC:
i. Chuẩn bị một đĩa 24 giếng như mô tả ở các bước 1 - 3.
ii. Nhẹ nhàng dùng pipet hút lên xuống trong giếng để đảm bảo tất cả các tế bào đều ở trạng thái huyền phù.
Lưu ý: Không cạo đáy đĩa hoặc huyền phù quá mạnh vì điều này sẽ làm bong ra bất kỳ tế bào bám dính nào đã phát triển.
iii. Chuyển dịch huyền phù từ một giếng sang một giếng của đĩa mới phủ. Lặp lại cho tất cả các giếng.
iv. Ủ ở nhiệt độ 37°C và 5% CO2 trong 3 hoặc 4 ngày, sau đó tiến hành bước 10.
Ngày 10 hoặc 11
10. Thực hiện thay một nửa môi trường như sau:
a. Cẩn thận hút 500 µL môi trường ra khỏi giếng. Không làm xáo trộn tế bào.
b. Thêm 500 µL StemSpan™ Lymphoid Progenitor Expansion Medium vào mỗi giếng. Ủ ở 37°C và 5% CO2 trong 3 hoặc 4 ngày.
Lưu ý: Nếu tế bào đạt đến độ hợp lưu trước khi thu hoạch hoặc môi trường thay đổi trong phần còn lại của quy trình, hãy giảm mật độ tế bào bằng cách hút lên và xuống, loại bỏ một nửa môi trường có chứa tế bào và thay thế bằng môi trường mới.
Ngày 14 - Thu tế bào và cấy chuyền
11. Nhẹ nhàng hút các tế bào lên xuống trong giếng để đảm bảo tất cả các tế bào đều ở trạng thái lơ lửng. Chuyển các tế bào vào một ống thích hợp; các tế bào này bao gồm các tế bào tiền thân lymphoid.
Lưu ý: Tế bào có thể được bảo quản đông lạnh ở giai đoạn này bằng CryoStor ® CS10 (#07930). Tham khảo PIS cho CryoStor ® CS10 để biết hướng dẫn bảo quản đông lạnh và rã đông. Sau khi tế bào được rã đông, hãy tiến hành bước 12.
12. Thực hiện đếm tế bào sống bằng Trypan Blue và buồng đếm hồng cầu.
13. Thêm tế bào ở mức 1 x 105 tế bào/mL vào 500 µL StemSpan™ NK Cell Differentiation Medium.
Lưu ý: Dung dịch tế bào này dành cho một giếng của đĩa 24 giếng. Nếu sử dụng dụng cụ nuôi cấy khác, hãy tham khảo Bảng 1 để biết thể tích cần thiết.
14. Thêm 500 µL dung dịch huyền phù tế bào (đã chuẩn bị ở bước 13) vào một giếng (5x104 tế bào/giếng) của đĩa 24 giếng không xử lý bề mặt (#21024010). Ủ ở 37°C và 5% CO2 trong 3 hoặc 4 ngày.
Ngày 17 hoặc 18
15. Thêm từ từ 500 µL StemSpan™ NK Cell Differentiation Medium vào mỗi giếng. Ủ ở 37°C và 5% CO2 trong 3 hoặc 4 ngày.
Ngày 21
16. Thực hiện thay một nửa môi trường như sau:
a. Cẩn thận hút 500 µL môi trường ra khỏi giếng. Không làm xáo trộn tế bào.
b. Thêm 500 µL StemSpan™ NK Cell Differentiation Medium vào mỗi giếng. Ủ ở 37°C và 5% CO2 trong 3 hoặc 4 ngày.
Ngày 24 hoặc 25
17. Thực hiện thay một nửa môi trường như sau:
a. Cẩn thận lấy 500 µL môi trường ra khỏi giếng. Không làm xáo trộn tế bào.
b. Thêm 500 µL StemSpan™ NK Cell Differentiation Medium vào mỗi giếng. Ủ ở 37°C và 5% CO2 trong 3 hoặc 4 ngày.
Ngày 28 - Thu hoạch tế bào
18. Nhẹ nhàng hút tế bào lên xuống để đảm bảo tất cả các tế bào đều ở trạng thái huyền phù. Chuyển tế bào vào ống thích hợp. Các tế bào NK này đã sẵn sàng để xét nghiệm hoặc phân tích khi cần thiết.
4.3 Đánh giá kiểu hình
Để đánh giá kiểu hình của tế bào tiền thân lymphoid bằng phương pháp flow cytometry, hãy sử dụng các kháng thể liên hợp huỳnh quang sau:
· Anti-Human CD5 Antibody, UCHT2 (#60082)
· Anti-Human CD7 Antibody, Clone CD7-6B7
Để đánh giá kiểu hình của tế bào NK bằng phương pháp flow cytometry, hãy sử dụng các kháng thể liên hợp với huỳnh quang sau đây:
· Anti-Human CD16 Antibody, Clone 3G8 (#60041)
· Anti-Human CD56 Antibody, Clone HCD56 (#60021)
· Anti-human CD94 Antibody, Clone DX22
· Anti-human CD158 (KIR) Antibody, Clone 180704 and/or HP-MA4
· Anti-human CD335 (NKp46) Antibody, Clone 9E2
· Anti-human CD336 (NKp44) Antibody, Clone P44-8
· Anti-human CD337 (NKp30) Antibody, Clone P30-15
· Anti-human NKG2D Antibody, Clone 1D11

Hình 2. Tần suất và hiệu suất tế bào NK CD56+ sau 28 ngày nuôi cấy
Tế bào CD34+ có nguồn gốc từ CB (mới phân lập hoặc đông lạnh) được nuôi cấy bằng StemSpan™ NK Cell Generation Kit trong 28 ngày. Các tế bào được thu hoạch và phân tích biểu hiện (A, B) CD56 và (A) NKp46 bằng phương pháp flow cytometry. Các tế bào chết được loại trừ bằng phương pháp tán xạ ánh sáng và nhuộm màu tế bào sống. (B) Tần suất tế bào sống trung bình của tế bào NK CD56+ vào ngày thứ 28 là 77%, với ~9.000 tế bào CD56+ được sản xuất trên mỗi tế bào CD34+ có nguồn gốc từ CB đầu vào. Hiển thị là giá trị trung bình với khoảng tin cậy 95% (n = 45: 23 mẫu tế bào mới phân lập và 22 mẫu tế bào CD34+ đông lạnh). Các tế bào CD34+ có nguồn gốc từ BM cũng được biệt hóa thành các tế bào NK bằng StemSpan™ NK Cell Generation Kit. Hiệu suất của tế bào NK từ BM HSPC thường thấp hơn so với CB, trung bình khoảng 75 trên mỗi tế bào CD34+ đầu vào (n = 3, dữ liệu không được hiển thị).
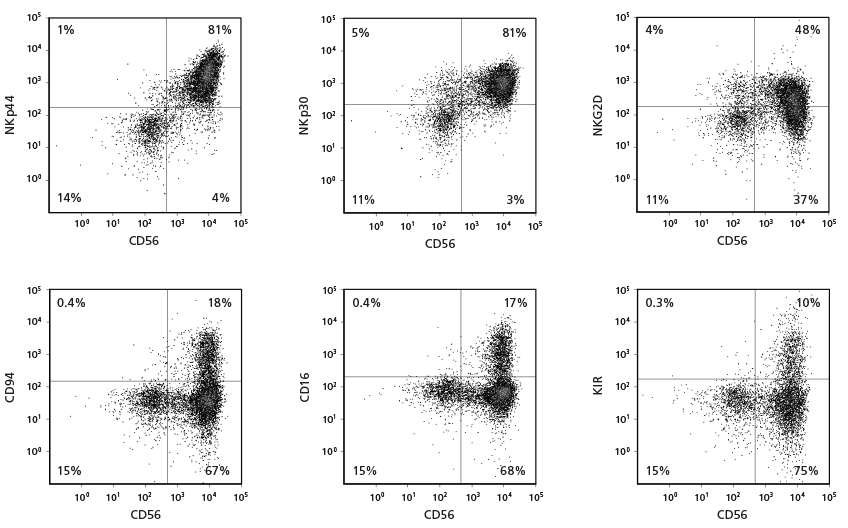
Hình 3. Biểu hiện dấu hiệu bề mặt tế bào trên các tế bào NK CD56+ sau 28 ngày nuôi cấy
Các tế bào CD34+ có nguồn gốc từ CB được nuôi cấy bằng StemSpan™ NK Cell Generation Kit trong 28 ngày. Các tế bào đã biệt hóa được thu hoạch và phân tích bằng phương pháp flow cytometry cho biểu hiện CD56, NKp44, NKp30, NKG2D, CD94, CD16 và KIR. Việc nhuộm các phân tử KIR được thực hiện bằng cách kết hợp hai bản sao cho kháng thể, 180704 và HP-MA4, vì mỗi bản sao nhận diện một tập hợp con riêng biệt của các phân tử KIR.

Hình 4. Tế bào NK nuôi cấy thể hiện độc tính đối với dòng tế bào K562
Tế bào NK được tạo ra từ tế bào CD34+ có nguồn gốc từ CB trong 28 ngày bằng cách sử dụng quy trình ở Hình 1. Vào ngày 28, các tế bào được thu hoạch, nhuộm cho CD56 và đếm các tế bào CD56+ sống. Các tế bào K562 được ủ với 8 μM calcein AM ở 37°C trong 1 giờ và sau đó rửa hai lần. Sau đó, các tế bào NK CD56+ được kết hợp với 10.000 tế bào mục tiêu K562 được gắn nhãn calcein AM này theo tỷ lệ Tác nhân: Mục tiêu là 5:1 trong các đĩa 96 giếng đáy chữ U và đồng nuôi cấy (co-cultured) ở 37°C trong 4 giờ. Các tế bào NK máu ngoại vi người lớn (adult) (PB) và các tế bào đơn được phân lập bằng EasySep™ được sử dụng làm đối chứng dương tính và âm tính. Tế bào PB NK được nuôi qua đêm với NK Cell Differentiation Supplement và SFEM II, trong khi các tế bào đơn PB chỉ được nuôi qua đêm trong SFEM II. Để phát hiện sự giải phóng tự phát, kiểm soát các giếng đối chứng chỉ chứa các tế bào mục tiêu K562 được gắn nhãn calcein AM đã được thiết lập. Các tế bào K562 được gắn nhãn được xử lý bằng 1% Triton™ X-100 để đo sự giải phóng tối đa. Sau khi ủ, các đĩa được ly tâm ở tốc độ 500 x g trong 5 phút và 100 μL dịch nổi được chuyển vào các đĩa đen và phân tích bằng đầu đọc vi mảng SpectraMax® (kích thích 485 nm/phát xạ 530 nm). Kết quả được biểu thị dưới dạng % ly giải đặc hiệu: [(thử nghiệm giải phóng - giải phóng tự phát) x 100] / (giải phóng tối đa - giải phóng tự phát). Các tế bào NK có nguồn gốc từ CB CD34+ cho thấy hoạt động tiêu diệt tương tự đối với các tế bào đích K562 so với các tế bào PB NK. Hiển thị giá trị trung bình ± SD (tế bào NK có nguồn gốc từ CB CD34+: n = 18, tế bào NK và tế bào đơn PB: n = 7).
Nguồn bài viết | STEMCELL Technologies