

Tế bào gốc là các tế bào đặc biệt có khả năng tự làm mới một cách đặc trưng, tạo ra một nguồn tế bào gốc chưa biệt hóa mới. Chúng cũng có khả năng biệt hóa thành các loại tế bào đặc hiệu theo dòng (lineage-specific) với các chức năng chuyên biệt và đã trưởng thành. Vì vậy, tế bào gốc được coi là những “viên gạch nền tảng” của các mô và cơ quan nơi chúng tồn tại.
Trong số nhiều loại tế bào gốc, tế bào gốc tạo máu (Hematopoietic Stem Cells - HSCs) là loại tế bào gốc trưởng thành được nghiên cứu nhiều nhất và được coi là nguồn tế bào đầy hứa hẹn cho các ứng dụng trong khoa học cơ bản và y học lâm sàng. Về mặt lịch sử, nghiên cứu về HSCs bắt đầu từ những năm 1940, khi một thí nghiệm mang tính đột phá cho thấy các tế bào tủy xương (Bone Marrow - BM) được tiêm tĩnh mạch có thể ngăn ngừa cái chết ở chuột bị chiếu xạ bằng cách phục hồi quá trình sản xuất tế bào máu. Từ đó đến nay, HSCs đã được nghiên cứu và ứng dụng trong các liệu pháp y tế và nghiên cứu khoa học trong suốt nhiều thập kỷ.
Theo thời gian, nhiều công cụ tinh vi hơn đã được phát triển để đánh giá hành vi của các nhóm tế bào tạo máu tinh khiết có khả năng tạo ra các tế bào máu. Một trong những công cụ đáng tin cậy nhất là phương pháp thử nghiệm đơn vị tạo cụm (Colony-Forming Units - CFUs Assay). Phương pháp này giúp nhận diện, đếm số lượng và phân tích các cụm tế bào được hình thành từ các tế bào gốc và tiền thân tạo máu (Hematopoietic Stem and Progenitor Cells - HSPCs) đã biệt hóa thuộc các dòng myeloid, erythroid và lymphoid.
Tế bào gốc và tiền thân tạo máu (HSPCs) là quần thể hỗn hợp bao gồm các tế bào gốc và tế bào tiền thân tạo máu được tìm thấy trong cơ thể. Trong đó, tế bào tiền thân tạo máu (HPCs) là các tế bào đã được định hướng biệt hóa, có khả năng biệt hóa đa năng (multi-potent), nhị năng (bi-potent), hoặc đơn năng (uni-potent) để tạo ra các tế bào máu trưởng thành hơn. Mỗi năm, cơ thể con người sản xuất khoảng 1.4 x 10¹⁴ tế bào máu mới, bao gồm khoảng 1.75 x 10¹¹ hồng cầu, 7 x 10¹⁰ bạch cầu hạt, và 1.75 x 10¹¹ tiểu cầu. Cân bằng quá trình tạo máu (homeostasis of hematopoiesis) đảm bảo rằng các tỷ lệ phù hợp của các tế bào tiền thân khác nhau được sản xuất để đáp ứng nhu cầu của cơ thể khi bị nhiễm trùng hoặc chấn thương.
Tế bào gốc tạo máu (hematopoietic stem cells) có khả năng tự làm mới và biệt hóa thành các dòng tế bào máu khác nhau. Từ tế bào gốc này, quá trình biệt hóa sẽ phân tách thành hai dòng chính: dòng tủy (myeloid progenitor cells) và dòng lympho (lymphoid progenitor cells). Dòng tủy tạo ra các loại tế bào như bạch cầu ưa axit (eosinophil), bạch cầu ưa kiềm (basophil), bạch cầu trung tính (neutrophil), đại thực bào (monocyte), tiểu cầu (platelets), và hồng cầu (erythrocytes). Trong khi đó, dòng lympho biệt hóa thành các tế bào miễn dịch quan trọng như tế bào T (T-cell) và tế bào B (B-cell). Điều này cho thấy vai trò quan trọng của HSPCs trong việc duy trì sự cân bằng và phát triển của hệ thống tạo máu trong cơ thể.

Nguồn ảnh: https://www.medicalnewstoday.com/articles/285666#donation

Có nhiều loại xét nghiệm đặc tính cho HSPC và xét nghiệm phù hợp phụ thuộc vào độ trưởng thành của tế bào mà bạn quan tâm. Nói chung, xét nghiệm có thể là xét nghiệm kiểu hình (phenotypic assay) hoặc xét nghiệm chức năng (functional assay).
Các phương pháp xét nghiệm kiểu hình (phenotypic assays), như kỹ thuật dòng chảy tế bào (flow cytometry), được sử dụng để khảo sát các dấu ấn bề mặt tế bào, chẳng hạn như CD34 – một loại phospho-glyco-protein xuyên màng được phát hiện đầu tiên trên HSPCs, mặc dù cũng có mặt trên các loại tế bào khác như mô mạch máu (vascular tissue).

Ngược lại, các phương pháp xét nghiệm chức năng (functional assays) đo lường các đặc tính sinh học cụ thể cho thấy chức năng của tế bào. Các phép thử này có thể được thực hiện thông qua phương pháp in vivo hoặc in vitro, mỗi phương pháp đều có những ưu điểm và nhược điểm riêng.
Phương pháp tốt nhất để đánh giá chức năng của tế bào gốc tạo máu (HSCs) là phương pháp ghép tế bào trên chuột in vivo (mouse engraftment assay), tương tự như thí nghiệm của Till & McCulloch vào những năm 60. Tuy nhiên, loại phép thử này thường tốn nhiều thời gian, chi phí cao và khó đánh giá. Do đó, phép thử CFU in vitro được khuyến nghị sử dụng để đánh giá chất lượng của HSPCs trước khi cấy ghép, vì nó đã được chứng minh có tương quan tốt với các mô hình ghép tế bào in vivo.
In vivo In vivo assays: Dựa trên mô hình cấy ghép trên động vật, phương pháp này đánh giá sự hình thành tế bào đa dòng sau hơn 5 tuần. | In vitro In vitro assays: Phương pháp CFU (Colony Forming Unit) được sử dụng để đánh giá sự phát triển của tế bào tiền thân (progenitor) và khả năng biệt hóa của chúng. |
 |  |
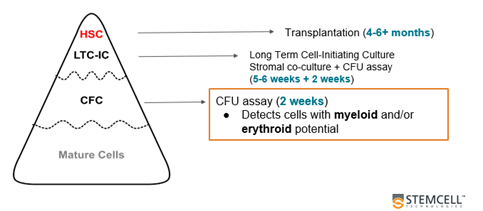
Trước hết, mặc dù các phép thử chức năng khác như nghiên cứu cấy ghép trên chuột in vivo hoặc xét nghiệm tế bào khởi đầu nuôi cấy dài hạn (Long-Term Culture-Initiating Cell, LTC-IC) thường phù hợp hơn trong việc đánh giá chức năng của các HSPCs nguyên thủy, nhưng chúng lại rất phức tạp và tốn nhiều thời gian – có thể kéo dài từ 5 tuần đến 6 tháng để hoàn thành. Ngược lại, CFU assay chỉ mất khoảng 2 tuần, giúp đánh giá nhanh hơn đáng kể.
Hơn nữa, CFU assay từ lâu đã được chứng minh là có mối tương quan chặt chẽ với sự ghép thành công ở bệnh nhân được cấy ghép. Nghiên cứu của KM Page (2011) cho thấy "liều lượng CFU" có liên quan chặt chẽ nhất đến sự ghép của bạch cầu trung tính và tiểu cầu. Điều này chứng tỏ CFU assay không chỉ đánh giá tiềm năng sinh cụm mà còn dự đoán chính xác hiệu quả cấy ghép trong lâm sàng.
Với thời gian thực hiện ngắn và khả năng dự đoán chính xác hiệu quả ghép tế bào, CFU assay là lựa chọn lý tưởng cho việc đánh giá chất lượng của HSPCs trước khi cấy ghép. CFU assay được xem là tiêu chuẩn vàng trong đánh giá hiệu lực của các sản phẩm tế bào gốc vì nó có mối tương quan với tỷ lệ ghép thành công và tỷ lệ sống sót tổng thể ở những người nhận ghép HSCs (Velier và cộng sự, 2019).
Đối với các ngân hàng máu cuống rốn (Cord blood banks) ở Mỹ, tất cả đều phải được đăng ký với FDA. Hầu hết các ngân hàng này đều được chứng nhận bởi AABB hoặc FACT, và cả hai tổ chức này đều yêu cầu dữ liệu CFU trước khi đông lạnh (pre-freeze CFU data).
FDA yêu cầu thử nghiệm độ ổn định và đề xuất CFU assay cụ thể: "Chương trình kiểm tra độ ổn định nên bao gồm, nhưng không giới hạn ở, hiệu lực (potency), tính toàn vẹn (integrity) và vô trùng (sterility) của sản phẩm. Dữ liệu phòng thí nghiệm phi lâm sàng, chẳng hạn như CFU assay in vitro, có thể được sử dụng như một phần của chương trình kiểm tra độ ổn định, kèm theo dữ liệu cấy ghép lâm sàng nếu có." (FDA-2006-D-0157)
Tiêu chuẩn FACT – JACIE (8th edition):
FACT yêu cầu cần có chương trình đánh giá ổn định hằng năm về tỉ lệ sống và hiệu lực (viability and potency) của các sản phẩm trị liệu tế bào được bảo quản đông lạnh. (D9.2.3)
Đánh giá phải được thực hiện trên mẫu: đại diện cho tất cả phương pháp xử lý (all processing methods) và đại diện cho thời gian lưu mẫu tối đa (maximum storage duration). (D9.2.3.1).
Tiêu chuẩn AABB (11th edition):
Chương trình đánh giá ổn định phải bao gồm: Tính toàn vẹn của bao bì chứa sản phẩm (product container integrity); khả năng thu hồi tế bào sống (viable cell recovery); và đánh giá hiệu lực (measure of potency) của các tế bào liên quan. (5.20.2.1). Phương pháp đánh giá hiệu lực liên quan (Relevant potency assay) phải được xác định bởi cơ sở thực hiện (defined by the facility). (5.17C, 5a).
NetCord-FACT Banking Standards (8th Edition - DRAFT):
Phải có bằng chứng về hiệu lực (evidence of potency) thông qua CFU assay hoặc các phép thử hiệu lực đã được xác thực (other validated potency assay) trên mẫu tươi sau khi xử lý (fresh post-processing sample). Đồng thời, trên mẫu đại diện trước khi phát hành cho chương trình lâm sàng (representative sample prior to release to the clinical program). (D9, appendix V)

https://www.factglobal.org/standards/cbb 1
Điều này nhấn mạnh tầm quan trọng của CFU assay trong việc đảm bảo chất lượng và hiệu lực của các sản phẩm máu cuống rốn trước khi sử dụng cho mục đích cấy ghép lâm sàng.

Để kiểm soát sự biến thiên của CFU Assay, cần sử dụng các hóa chất đạt chuẩn và có tính ổn định lâu dài. Điều này đảm bảo tính nhất quán và độ tin cậy của phép thử. Một ví dụ điển hình là MethoCult medium – sản phẩm đã được STEMCELL Technologies cung cấp hơn 30 năm, đảm bảo tính ổn định và chất lượng cho CFU Assay. Ngoài ra, tiêu chuẩn hóa quy trình thao tác cũng rất quan trọng bằng cách thực hiện các quy trình thao tác chuẩn (SOPs) và đảm bảo đào tạo nhân viên đầy đủ để duy trì tính nhất quán trong kỹ thuật và phân tích. Để hỗ trợ điều này, STEMCELL Technologies cung cấp tài liệu giáo dục và chương trình kiểm tra trình độ nhằm nâng cao năng lực chuyên môn. Bên cạnh đó, việc nhận diện và đếm cụm khuẩn lạc hình thành – khâu có tính chủ quan cao nhất trong CFU Assay – cần được tiêu chuẩn hóa thông qua đào tạo nghiêm ngặt cho người thực hiện thủ công để đảm bảo sự chính xác và nhất quán. Tuy nhiên, tự động hóa được khuyến nghị sử dụng để giảm thiểu sự sai lệch giữa các người thao tác, cải thiện tính nhất quán và tăng tốc độ phân tích dữ liệu. Những biện pháp này giúp giảm thiểu sự biến thiên trong CFU Assay, từ đó tăng tính chính xác và độ tin cậy của kết quả phân tích.