Các câu hỏi thường gặp về việc thực hiện nuôi cấy cụm tế bào (CFU Assay)
Nuôi cấy cụm tế bào (CFU) in vitro được sử dụng để đánh giá chức năng của tế bào gốc, tế bào tiền thân tạo máu (HSPC) và đã được chứng minh là có tương quan tốt với các mô hình nuôi cấy in vivo. Tại đây, Tiến sĩ Jackie Damen (Cố vấn Khoa học Cấp cao, STEMCELL Technologies) trả lời các câu hỏi thường gặp (FAQ) về việc thực hiện nuôi cấy CFU tế bào gốc tạo máu.
Chuẩn bị môi trường
Tôi nên sử dụng loại môi trường MethoCult ™ nào?
Dòng sản phẩm MethoCult™ bao gồm nền môi trường methylcellulose và các chất bổ sung với huyết thanh và cytokine tiêu chuẩn được tối ưu hóa cho sự phát triển của các cụm tế bào từ tế bào gốc tạo máu của người hoặc chuột. MethoCult ™ H4034 Optimum là sự lựa chọn phù hợp nhất cho các tế bào nguyên sơ tủy và hồng cầu từ tủy xương người (BM), máu cuống rốn (CB) và tế bào đơn nhân máu ngoại vi (PBMNCs). STEMCELL Technologies cũng cung cấp các môi trường không chứa huyết thanh và các phiên bản không chứa cytokine, tùy thuộc vào nhu cầu của khách hàng.
Tại sao nên rã đông môi trường nền metylcellulose của MethoCult ™ ở nhiệt độ phòng hoặc trong tủ lạnh thay vì ở 37°C?
MethoCult™ nên được rã đông ở nhiệt độ phòng vì methylcellulose trong các sản phẩm MethoCult™ đông lạnh không đồng nhất và có thể xuất hiện “vón cục” nhỏ nếu sản phẩm được rã đông nhanh ở 37°C.
Nếu sản phẩm vô tình bị rã đông ở 37°C, hãy đặt chai MethoCult™ trên đá trong 1 - 2 giờ hoặc trong tủ lạnh trong 2 - 3 giờ (các “vón cục” sẽ không tan ở 37°C). Lắc mạnh chai trong 1 - 2 phút trước khi pha môi trường.
Làm cách nào để chuẩn bị môi trường nền Metylcellulose của MethoCult ™ khi sử dụng?
Nồng độ và kích thước polyme có thể ảnh hưởng đến độ nhớt của MethoCult ™. Đối với nuôi cấy tế bào, độ nhớt cần đủ thấp để không hạn chế chuyển động của tế bào trong quá trình phân chia tế bào. Do đó, trước khi lấy MethoCult ™ từ chai 100 ml, điều quan trọng là phải trộn đều chai sau khi rã đông.
Hỗn hợp dung dịch tế bào đậm đặc 10x được chuẩn bị để thêm vào các phần nhỏ của môi trường MethoCult ™ để nuôi cấy. Thêm quá nhiều thể tích tế bào vào MethoCult ™ có thể làm loãng môi trường ban đầu.
Môi trường MethoCult™ của tôi xuất hiện màu vàng hoặc tím sau khi rã đông. Tôi có thể sử dụng nó không?
Có, bạn có thể sử dụng môi trường MethoCult ™ có màu vàng hoặc tím sau khi rã đông. Điều này cho thấy rằng độ pH của môi trường đã bị thay đổi trong quá trình vận chuyển hoặc bảo quản nhưng hiệu suất không bị ảnh hưởng, miễn là môi trường được bảo quản ở phạm vi nhiệt độ khuyến nghị từ -25 ° C đến -15 ° C và được sử dụng trước ngày hết hạn ghi trên nhãn. Rã đông chai và làm theo quy trình được khuyến nghị để thiết lập xét nghiệm nuôi cấy CFU. Độ pH sẽ tự điều chỉnh khi các mẫu cấy được ủ trong điều kiện 5% CO2.
Có cần thiết phải thêm kháng sinh vào môi trường không?
Không. Trong khí đó chúng ta phải đảm bảo kỹ thuật vô trùng trong suốt quá thực hiện nuôi cấy. Tuy nhiên, nếu muốn thuốc kháng sinh (Penicillin/Streptomycin) hoặc thuốc chống nấm (Amphotericin B) có thể được thêm vào môi trường methylcellulose.
Tại sao đĩa nuôi cấy có độ bám dính thấp lại quan trọng đối với CFU?
Các đĩa có độ bám dính thấp rất quan trọng vì các tế bào kết dính như nguyên bào sợi có thể ức chế sự phát triển của cụm tế bào và che khuất hình ảnh của cụm tế bào. Nên lựa chọn đĩa có độ bám dính thấp để hạn chế sự phát triển của các tế bào kết dính.
Làm cách nào để chuẩn bị một số lượng lớn môi trường MethoCult ™ hoàn chỉnh để thiết lập các mẫu cấy ba lần lăp lại (triplicate cultures) hoặc hai lần lăp lại (duplicate cultures)?
Có thể chuẩn bị nhiều môi trường MethoCult ™ từ các chai 100 mL môi trường MethoCult ™ hoàn chỉnh. Việc chiết môi trường ra được khuyến khích để tránh tình trạng băng lạnh và rã đông lặp lại nhiều lần.
Không sử dụng pipet hút huyết thanh để phân phối môi trường nền methylcellulose vì thể tích lấy sẽ không chính xác. Bơm tiêm (3 mL hoặc 6 mL) và Kim đầu cùn, 16 Gauge nên được sử dụng để phân phối chính xác môi trường methylcellulose nhớt. Đối với các mẫu cấy lặp lại 2 lần, lấy 3 mL mỗi ống. Đối với các mẫu cấy lặp lại ba lần, lấy 4 mL mỗi ống.
Thiết lập và nuôi cấy
Tại sao làm suy giảm tế bào hồng cầu lại quan trọng trước khi thiết lập nuôi cấy CFU?
Làm suy giảm tế bào hồng cầu (RBC) là điều quan trọng trước khi thiết lập nuôi cấy CFU vì sự hiện diện của nhiều RBC trong mẫu có thể gây ra nền dầy đặc, sần sùi, ảnh hưởng đến chất lượng cũng như khẳ năng quan sát các cụm tế bào.
Tôi nên sử dụng lượng tế bào là bao nhiêu để bắt đầu nuôi cấy CFU?
Để định lượng chính xác, cần có mối quan hệ tuyến tính giữa số lượng tế bào được sử dụng để bắt đầu nuôi cấy CFU và số lượng cụm tế bào mong muốn thu được. Sự hiện diện của quá nhiều cụm tế bào gây ra sự ức chế sự tăng sinh của các tế bào tiền thần do cạn kiệt chất dinh dưỡng cần thiết, thay đổi pH và sự trao đổi chất của tế bào. Việc các cụm tế bào chồng quá mức cũng gây ra sai số đếm vì khó xác định các cụm tế bào riêng lẻ. Hoặc quá ít cụm tế bào có thể mang lại dữ liệu không chính xác về mặt thống kê.
Sau đây là bảng nồng độ tế bào cũng như là nồng độ đổ đĩa được đề xuất với môi trường MethoCult:
Bảng 1. Nồng độ khuyến nghị đổ đĩa cho môi trường MethoCult
|
NGUỒN TẾ BÀO |
NỒNG ĐỘ 10X ĐƯỢC CHUẨN BỊ |
NỒNG ĐỘ ĐỔ ĐĨA |
|
BM, được xử lý bằng ammonium chloride |
5 x 105 |
5 x 104 |
|
BM MNCs |
2 x 105 |
2 x 104 |
|
CB MNCs |
1 x 105 |
1 x 104 |
|
PB MNCs |
2 x 106 |
2 x 105 |
|
MPB MNCs |
2 x 105 |
2 x 104 |
|
Lin-depleted (CD34+ |
1 x 104 |
1000 |
|
CD34+ cells (BM, CB, MPB) |
5 x 103 |
500 |
*Những số này áp dụng cho môi trường MethoCult ™ có chứa các cytokine tái tổ hợp. Nồng độ đổ đĩa khuyến nghị cho môi trường MethoCult ™ # 04431, 04531 cao hơn 1,5 đến 2,5 lần, vì hiệu quả đổ đĩa trong các môi trường này này có xu hướng thấp hơn.
Tại sao môi trường MethoCult ™ không phủ toàn bộ bề đĩa nuôi cấy?
Do độ nhớt của nó, MethoCult ™ không phủ ngay đáy giếng và không giống như môi trường lỏng, nó sẽ tạo thành mái vòm do sức căng bề mặt. Để trải các tế bào và MethoCult ™, hãy phân phối đều môi trường (1,1 mL) bằng cách nghiêng và xoay nhẹ đĩa để tạo lớp đều đến mép của đĩa.
Nên đợi bao lâu sau khi vortex trước khi đổ đĩa các ống MethoCult ™ có tế bào vào đĩa nuôi cấy?
Có thể đổ đĩa MethoCult ™ và hỗn hợp tế bào ngay khi các bọt khí gần như bốc lên trên cùng (khoảng 5 phút sau khi vortex). Vì đây là hỗn hợp trong đó các tế bào được nuôi cấy, các tế bào có thể được để trong ống trong vài giờ ở nhiệt độ phòng, nếu cần, mà không ảnh hưởng xấu đến sự hình thành cụm tế bào. Vortex nhẹ trước khi đổ đĩa nếu ống đã được để trong một thời gian.
Tại sao môi trường MethoCult ™ có vẻ bị lỏng và các cụm tế bào nổi hoặc nhòe?
Có một số lý do tiềm ẩn khiến môi trường MethoCult ™ có thể bị lỏng và các cụm tế bào bị nổi hoặc nhòe:
- Môi trường MethoCult ™ đã rã đông không được trộn kỹ trước khi phân phối vào ống. Việc này có thể dẫn đến sự thay đổi độ nhớt của môi trường trong các ống (tức là một số ống sẽ chứa môi trường có độ nhớt thấp hơn và một số ống chứa môi trường có độ nhớt cao hơn).
- Thể tích tế bào quá lớn đã được thêm vào MethoCult ™. MethoCult ™ được pha sẵn với độ nhớt tối ưu để hình thành cụm tế bào theo tỷ lệ 1:10, do đó, nếu độ pha loãng lớn hơn 1:10 sẽ dẫn đến các cụm tế bào hình thành rời rạc và có thể xuất hiện 'thành dòng' trên đĩa khi đĩa được chuyển đi. Ngược lại, tỷ lệ nhỏ hơn 1:10 sẽ dẫn đến hình thành các cụm tế bào cực kỳ nhỏ và xuất hiện các bong bóng trong cụm tế bào.
- Các ống chứa tế bào và môi trường MethoCult ™ không được trộn kỹ trước khi đổ đĩa.
Tôi có thể làm gì nếu nền môi trường nuôi cấy bị nhiễm không?
Không, các nền môi trường nhiễm không thể cứu được. Một khi đã nhìn thấy sự nhiễm thì không thể cứu các mẫu cấy bằng cách bổ sung kháng sinh. Vi khuẩn và nấm men ức chế sự hình thành cụm tế bào bằng cách làm hút hết chất dinh dưỡng hoặc bằng cách giải phóng các chất độc vào môi trường.
Tại sao các nền môi trường bị khô? Làm cách nào để biết liệu nền môi trường có đang bị mất nước hay không?
Nguyên nhân phổ biến nhất gây ra các vấn đề mất nước là do chuẩn bị nuôi cấy không đúng cách, cụ thể là không sử dụng đĩa nước và độ ẩm quá thấp trong tủ ấm. Sự mất nước của mẫu cấy có thể xảy ra nếu độ ẩm cao (≥ 95%) không được duy trì trong suốt thời gian nuôi cấy, và ngay cả những thay đổi nhỏ về độ ẩm cũng có thể ảnh hưởng đến sự phát triển của cụm tế bào.
Thông thường, môi trường nuôi cấy mất nước sẽ xuất hiện lốm đốm hoặc vết nứt khi quan sát dưới kính hiển vi. Nếu nhìn vĩ mô từ một bên, môi trường nuôi cấy có vẻ mỏng hơn bình thường. Bạn cũng có thể quan sát thấy mật độ sần sùi bắt đầu từ một cạnh của giếng. Mất nước có thể dẫn đến không phát hiện được các cụm tế bào (thường ở vùng mất nước rất sần sùi) và/hoặc số lượng dương tính giả (thường là các cụm tế bào GM dọc theo vùng chuyển từ vùng mất nước sang vùng bình thường).
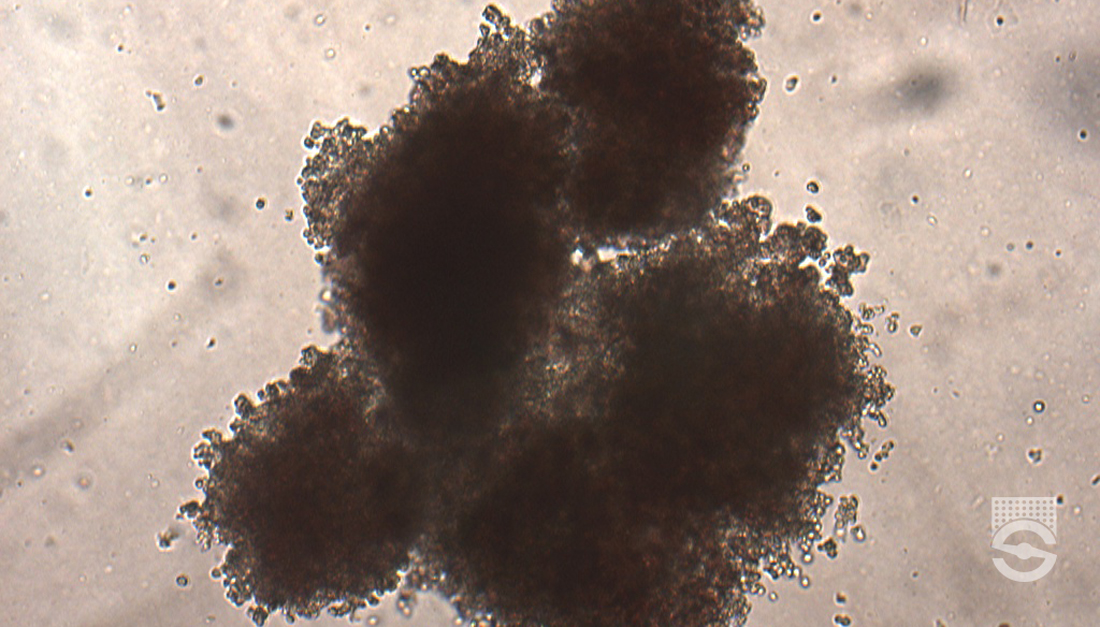
Xác định và liệt kê các cụm tế bào
Tại sao số lượng cụm tế bào không đồng đều trong ba lần nuôi cấy của cùng một mẫu?
Nếu bạn thấy số lượng cụm tế bào không đồng đều trong ba lần nuôi cấy của cùng một mẫu, có thể bạn đã không vortex các mẫu một cách chính xác. Sau khi thêm các tế bào vào môi trường MethoCult ™, điều rất quan trọng là phải vortex ít nhất 4 giây để tế bào phân bố đều.
Việc đếm của các xét nghiệm nuôi cấy CFU có mang tính chủ quan không?
Có, việc đếm các xét nghiệm nuôi cấy CFU có thể mang tính chủ quan. Một số hiện tượng phổ biến nhất và đặc biệt khó khăn gặp phải khi đếm các cụm tế bào CFU là sự xuất hiện của nhiều cụm tế bào quá gần nhau hoặc chồng lên nhau, do đó làm sai lệch tổng số đếm CFU, dẫn đến việc đánh giá sai mẫu HSPC đó.
Tôi cảm thấy chóng mặt khi đếm cụm tế bào. Làm thế nào để tôi có thể giảm bớt vấn đề này?
Những người mới đếm các xét nghiệm nuôi cấy CFU thường có cảm giác chóng mặt. Các cách để tránh điều này bao gồm:
- Giới hạn thời gian sử dụng kính hiển vi chỉ còn một giờ mỗi lần để bắt đầu.
- Đếm theo hàng dọc bằng cách di chuyển núm điều khiển lên và xuống thay vì từ bên này sang bên kia trên đĩa.
- Bắt đầu chậm: bắt đầu không đếm quá một giờ. Khi đã thực hành nhiều, bạn sẽ có thể chuyển sang đếm các cụm tế tào trong vài giờ một lần.
- Nghỉ giải lao! Ngay cả khi bạn cảm thấy tự tin, điều quan trọng là phải nghỉ giải lao mỗi giờ để vươn vai và nhìn vào khoảng không để thư giãn đôi mắt của bạn.
Có thể xác định đặc điểm của các tập hợp con của dòng bạch cầu hạt được phân biệt bằng xét nghiệm nuôi cấy CFU không?
Dòng bạch cầu hạt bao gồm ba loại tế bào trưởng thành: bạch cầu trung tính, bạch cầu ưa kiềm và bạch cầu ưa acid. Cách duy nhất để xác định thực sự tần số của chúng trong máu ngoại vi là dựa trên nhuộm mô học với hematoxylin và eosin (H&E) để đánh giá các đặc điểm hình thái liên quan để phân biệt ba loại này dựa trên kích thước, màu sắc và hình dạng của nhân.
Trong một xét nghiệm nuôi cấy CFU, người ta chỉ có kích thước của các tế bào trưởng thành để giúp xác định loại tổ tiên và không thể hình dung hình dạng của nhân. Hình dạng của nhân là yếu tố then chốt trong việc xác định sự khác biệt giữa chúng.
Tôi có thể để trường nuôi cấy CFU của người lâu hơn 14 ngày không?
Các mẫu cấy CFU của người không được để lâu hơn 14 ngày. Tất cả các mẫu cấy CFU của người trong môi trường MethoCult ™ tiêu chuẩn, chẳng hạn như MethoCult ™ H4435 Enriched, nên được tính vào khoảng ngày 13-15.
Các tế bào không thể ở trong môi trường nuôi cấy lâu hơn chủ yếu vì các chất dinh dưỡng trong môi trường sẽ bị cạn kiệt sau thời gian này. Tất cả các tế bào sẽ bắt đầu chết, bao gồm cả những tế bào sinh trưởng nguyên thủy mà bạn muốn xác định.
Ngoài ra, bạn không nên phân tích các mẫu cấy CFU sau hơn 15 ngày:
- Các cụm tế bào tiếp tục phát triển, gây khó khăn cho việc xác định và thống kê chính xác do kết quả tăng trưởng kéo dài dẫn đến quá tải, hợp nhất và chồng chéo
- Các cụm tế bào bắt đầu chết và phân hủy, như thường thấy với các cụm tế bào hồng cầu nhỏ.
Tuy nhiên, nếu bạn không thể đếm các mẫu cấy CFU trong khung thời gian khuyến nghị (13 - ~ 15 ngày) và bạn đang sử dụng môi trường MethoCult ™ tiêu chuẩn, nên chuyển các khay nuôi cấy CFU sang tủ ấm 33°C với 5% CO2 (Độ ẩm 95%) thêm 1 - 2 ngày. Nhiệt độ thấp hơn sẽ không ngăn chặn tế bào chết hoặc ức chế sự tăng sinh, nhưng sẽ hỗ trợ duy trì hình thái của cụm tế bào, do đó, các cụm tế bào vẫn có thể được thống kê một cách chính xác.
(Nguồn tài liệu: Công ty STEMCELL Technologies - Canada)