Cập nhật quy định & tầm quan trọng của NAT trong xét nghiệm Mycoplasma cho sản phẩm liệu pháp tế bào
Trong sản xuất các sản phẩm sinh học tiên tiến, đặc biệt là liệu pháp tế bào và gen (ATMP – Advanced Therapy Medicinal Products), việc kiểm soát nhiễm mycoplasma là một yêu cầu bắt buộc nhằm đảm bảo an toàn cho bệnh nhân. Nếu như trước đây ngành công nghiệp sinh học phụ thuộc chủ yếu vào phương pháp nuôi cấy 28 ngày theo tiêu chuẩn USP và FDA, thì hiện nay, cùng với sự phát triển của các quy định mới và đặc tính “thời gian lưu hành ngắn” của sản phẩm tế bào, phương pháp NAT (PCR-based Mycoplasma Testing) đã trở thành tiêu chuẩn gần như mặc định trong lot-release.
Bài viết này tổng hợp các thông tin cập nhật từ tài liệu chuyên ngành mới nhất, kết hợp cùng khung quy định hiện hành, nhằm giúp các phòng thí nghiệm, cơ sở sản xuất ATMP và các đơn vị nghiên cứu tại Việt Nam hiểu rõ:
- Vì sao NAT đang được ưu tiên bởi FDA, EMA và nhiều cơ quan quản lý.
- Các rào cản của phương pháp nuôi cấy và phương pháp enzyme.
- Vai trò của NAT trong bảo đảm chất lượng, an toàn bệnh nhân và tối ưu hóa vận hành sản xuất.
- Giải pháp MycoFinderTM cho xét nghiệm mycoplasma
Mục lục
ToggleMycoplasma – Mối nguy thực sự trong sản xuất liệu pháp tế bào
Mycoplasma là nhóm vi khuẩn có khả năng phát triển trên môi trường nhân tạo và được xem là những vi khuẩn nhỏ nhất có thể tự nhân lên. Về mặt phân loại học, thuật ngữ “mycoplasma” dùng để chỉ chung các loài thuộc lớp Mollicutes, bao gồm các chi như Mycoplasma, Ureaplasma, Spiroplasma và Acholeplasma. Hiện đã biết hàng trăm loài khác nhau, với hình thái rất đa dạng tuỳ theo chủng – từ dạng cầu, dạng sợi cho đến dạng xoắn. Khi nuôi cấy trên thạch, chúng thường tạo những khuẩn lạc có hình dạng đặc trưng giống “mắt trứng ốp la”.
Điểm đặc biệt của mycoplasma là không có thành tế bào, khiến chúng có tính mềm dẻo cao và có thể lọt qua màng lọc tiệt trùng 0,22 µm – loại mà thông thường có thể giữ lại phần lớn vi khuẩn khác. Đồng thời, do không có thành tế bào, mycoplasma không nhạy với kháng sinh nhóm beta-lactam, khiến việc kiểm soát nhiễm càng trở nên khó khăn. Trong tự nhiên, mycoplasma tồn tại rộng rãi ở cả động vật và thực vật, và thường biểu hiện tính đặc hiệu theo loài vật chủ.
Trong nuôi cấy tế bào, nguồn nguy cơ nhiễm có thể đến từ:
- Nguyên liệu đầu vào (huyết thanh, môi trường, supplement).
- Quy trình thao tác mở trong phòng sạch.
- Chính mẫu sinh học của bệnh nhân (đặc biệt là liệu pháp tự thân – autologous).
Một khi xảy ra nhiễm, hậu quả không chỉ dừng ở việc hủy lô sản phẩm, mà còn có thể gây:
- Lây nhiễm chéo sang các mẻ sản xuất khác.
- Tạm dừng toàn bộ dây chuyền sản xuất để điều tra nguyên nhân.
- Thiệt hại tài chính lớn và ảnh hưởng uy tín đơn vị.
Với sản phẩm tế bào dành cho điều trị, đặc biệt là bệnh nhân ung thư, nhiễm mycoplasma không chỉ gây mất tính toàn vẹn sinh học, mà còn có thể đe dọa tính mạng người bệnh nếu sản phẩm được truyền vào cơ thể.
Vì sao phương pháp nuôi cấy 28 ngày không còn phù hợp cho ATMP?
Theo FDA 21 CFR 610.30 và USP <63>, phương pháp nuôi cấy truyền thống yêu cầu:
- 28 ngày ủ trên môi trường lỏng và rắn.
- Kiểm tra dưới điều kiện hiếu khí và kỵ khí.
- Thao tác bởi kỹ thuật viên có kinh nghiệm cao.
Phương pháp này được xem như “tiêu chuẩn vàng” trong nhiều thập niên vì độ đặc hiệu tốt và khả năng nuôi được các chủng mycoplasma quan trọng.
Tuy nhiên, khi ngành công nghiệp phát triển các sản phẩm autologous cell therapy với thời gian sản xuất chỉ từ 5–7 ngày (như CAR-T), việc đợi 28 ngày để có kết quả lot-release là hoàn toàn bất khả thi.
Ngoài ra, ATMP không trải qua bước bất hoạt virus hoặc thanh lọc cuối như protein tái tổ hợp, khiến yêu cầu phát hiện mycoplasma càng khắt khe hơn.
Kết luận: phương pháp 28 ngày không thể đáp ứng nhu cầu tốc độ và an toàn của ngành ATMP.
Hạn chế của phương pháp enzyme trong Lot-Release ATMP
Mặc dù USP <63> phiên bản mới cho phép sử dụng các phương pháp dựa trên hoạt tính enzyme (enzymatic activity–based methods) như một lựa chọn thay thế cho xét nghiệm mycoplasma truyền thống, nhưng điều kiện mà tiêu chuẩn này đặt ra lại vô cùng khắt khe: phương pháp phải chứng minh được “tính tương đương” với quy trình nuôi cấy 28 ngày về độ nhạy và độ đặc hiệu. Trên lý thuyết, điều này có vẻ khả thi, nhưng trong thực tế sản xuất liệu pháp tế bào, đa số các phương pháp enzyme hiện nay đều không đáp ứng được yêu cầu này.
Một trong những hạn chế quan trọng nhất của enzymatic-based tests là độ nhạy không đáp ứng yêu cầu của cơ quan quản lý. Theo dược điển châu Âu (EP 2.6.7), phương pháp thay thế cho nuôi cấy 28 ngày phải đạt giới hạn phát hiện 10 CFU/mL. Điều này khiến chúng không thể vượt qua tiêu chí kỹ thuật để sử dụng trong lot-release sản phẩm liệu pháp tế bào.
Bên cạnh đó, phương pháp enzyme không phát hiện được mycoplasma đã chết, trong khi DNA từ các tế bào này vẫn có thể hiện diện trong nhiều mẫu nuôi cấy. PCR có thể nhận biết cả dạng sống và dạng chết, nhưng enzyme thì không, tạo ra nguy cơ bỏ sót và dẫn đến cảm giác an toàn giả trong quy trình sản xuất.
Một vấn đề khác là tính đặc hiệu kém. Enzymatic assay phản ứng với tín hiệu sinh học tổng thể thay vì nhận diện từng loài mycoplasma cụ thể, khiến chúng khó đáp ứng yêu cầu nghiêm ngặt của ATMP – nơi mức độ an toàn cho bệnh nhân là tuyệt đối.
Mặc dù có ưu điểm về tốc độ, phương pháp enzyme vẫn không được chấp nhận trong hồ sơ regulatory. Cho đến nay, chưa có sản phẩm ATMP nào được FDA hoặc EMA phê duyệt sử dụng enzymatic assay làm xét nghiệm mycoplasma cho lot-release. Trong khi đó, NAT/PCR đã chứng minh được độ nhạy, độ đặc hiệu và tính phù hợp thông qua nhiều trường hợp được phê duyệt thực tế.
NAT (PCR-based Testing) – Lựa chọn được FDA và EMA khuyến nghị
NAT, đặc biệt là PCR, đang trở thành phương pháp trung tâm trong kiểm nghiệm mycoplasma cho các sản phẩm liệu pháp tế bào. Nhiều hướng dẫn của FDA và EMA cho thấy các cơ quan quản lý đã sẵn sàng chấp nhận PCR như một giải pháp thay thế hợp lệ cho phương pháp nuôi cấy 28 ngày, miễn là phương pháp được thẩm định đầy đủ về độ nhạy và độ đặc hiệu.
FDA đã nêu rõ trong hướng dẫn CMC rằng với các sản phẩm có thời hạn sử dụng ngắn, chẳng hạn như liệu pháp tế bào tự thân, không thể áp dụng xét nghiệm nuôi cấy kéo dài. Trong những trường hợp này, cơ quan quản lý khuyến nghị sử dụng PCR-based mycoplasma assays nhằm đảm bảo kết quả nhanh mà vẫn đáp ứng yêu cầu an toàn.
Tại châu Âu, Dược điển châu Âu (EP 2.6.7) yêu cầu giới hạn phát hiện phải đạt 10 CFU/mL khi áp dụng phương pháp thay thế. PCR hoàn toàn đáp ứng được yêu cầu này, trong khi enzymatic-based assays thường không đạt đến mức độ nhạy cần thiết. Đây là lý do khiến NAT trở thành lựa chọn ưu tiên khi các cơ sở sản xuất muốn thay thế phương pháp truyền thống.
FDA cũng nhấn mạnh trong Final Rule 2020 rằng các phương pháp nhạy và đặc hiệu hơn đang được sử dụng rộng rãi và phù hợp với sự phát triển công nghệ hiện nay. Thông điệp này ngầm thể hiện sự ủng hộ đối với NAT, vốn là phương pháp hiện đại duy nhất đáp ứng được cả tốc độ lẫn tiêu chuẩn kỹ thuật nghiêm ngặt.
Nhờ đáp ứng tốt các yêu cầu về thời gian, độ nhạy và khả năng tích hợp vào quy trình sản xuất, NAT/PCR được xem là lựa chọn tối ưu trong lot-release của ATMP và hiện đã trở thành tiêu chuẩn được FDA và EMA khuyến nghị cho ngành liệu pháp tế bào.
MycoFinder™ – Giải pháp NAT tối ưu cho phát hiện Mycoplasma
Trong bối cảnh PCR trở thành tiêu chuẩn ưu tiên cho kiểm nghiệm mycoplasma trong các sản phẩm liệu pháp tế bào, bộ kit MycoFinder™ của Shimadzu nổi lên như một lựa chọn đáng tin cậy, đơn giản và hiệu quả cho các phòng thí nghiệm cần triển khai NAT một cách nhanh chóng. MycoFinder™ được thiết kế dưới dạng qPCR một bước, tích hợp đầy đủ enzyme, mồi và thuốc thử cần thiết trong cùng một bộ kit, giúp rút ngắn thời gian chuẩn bị mẫu và giảm sai số thao tác. Bộ kit cho phép phát hiện đồng thời nhiều chủng mycoplasma phổ biến với độ nhạy cao, thời gian trả kết quả nhanh, đáp ứng các yêu cầu kỹ thuật mà FDA và EMA đang hướng đến cho quy trình lot-release.
Ưu điểm của bộ kit MycoFinder™
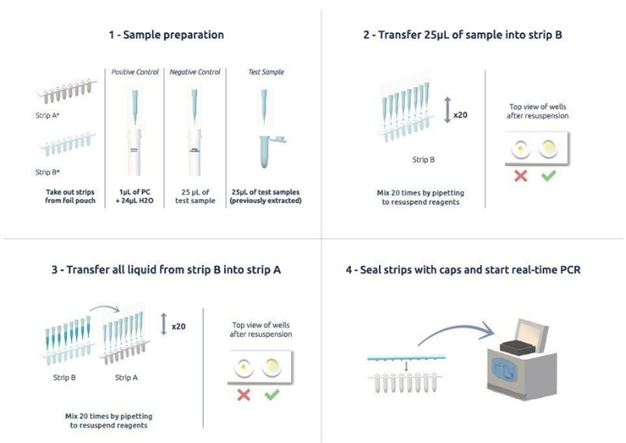
- Phát hiện nhanh trong ~1 giờ: Master Mix đã được định lượng trước trong mỗi tube, giúp giảm thiểu thời gian chuẩn bị mẫu và chu trình PCR (35 – 60 phút).
- Tuân thủ yêu cầu Dược điển Châu Âu, Nhật Bản, Hoa Kỳ (E.P.2.6.7; JP17, USP 63) về LOD, độ đặc hiệu: giới hạn phát hiện LOD dưới 10 CFU/mL; độ đặc hiệu cao – phát hiện đến 142 chủng Mycoplasma khác nhau (in silico)
- Hiệu quả chi phí & giảm nguy cơ nhiễm chéo: các strip đóng gói sẵn, bảo quản 2-8oC tối đa 12 tháng – chỉ sử dụng số lượng cần thiết cho mỗi lần chạy.
- Phù hợp cho cả nghiên cứu và QC sản xuất: Áp dụng tốt trong nuôi cấy tế bào, sản xuất sinh phẩm, liệu pháp tế bào và các phòng thí nghiệm kiểm nghiệm.
- Quy trình thực hiện đơn giản:
Xem thêm thông tin sản phẩm: Myco Finder™
Tài liệu tham khảo
1. Shimadzu Diagnostics Corporation. (n.d.). マイコプラズマ否定試験 | 再生医療分野 細胞培養関連サイト [Mycoplasma negative test / cell culture-related site]. Shimadzu Diagnostics. https://cell-culture.biz.sdc.shimadzu.co.jp/reagent/mycoplasma/
2. US Pharmacopeia, “63 Mycoplasma tests” (2012). Available at: https://bit.ly/36nDdae [3] Nims, Raymond W., and Elizabeth Meyers. “USP< 63> mycoplasma tests: a new regulation for mycoplasma testing.” BioPharm International 23.8 (2010): 54-59.
Danh mục
- Blog (66)
- Tin tức (45)
- Tuyển dụng (11)
- Sản Phẩm & Công Nghệ Mới (50)
- Đào Tạo & Webinar (25)
- Gian Hàng Ảo (1)


![[Infographic] Môi trường nuôi cấy thế hệ thứ 3: CD AOF (Chemically Defined & Animal Origin Free)](https://biogroupvietnam.com/wp-content/uploads/2026/02/infographic-moi-truong-nuoi-cay-the-he-thu-3-cd-aof-200x150.png)