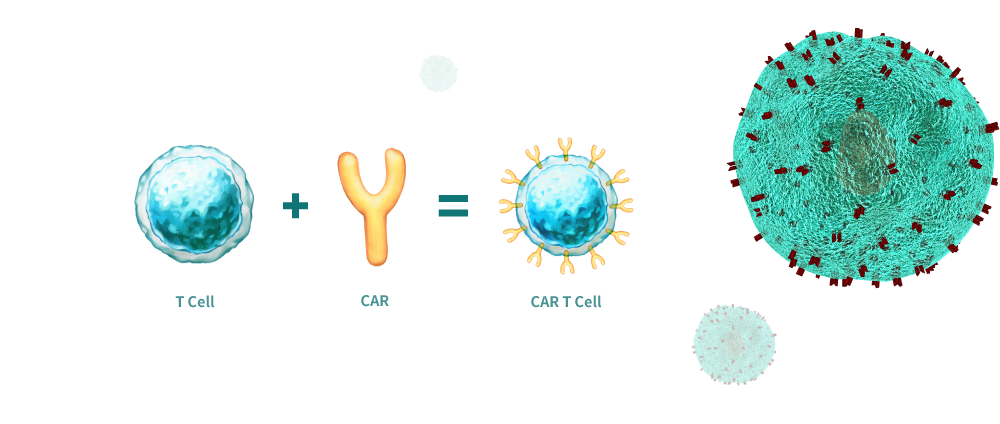Giải Pháp Toàn Diện Của Liệu Pháp Miễn Dịch
ADAM-MC2, ADAM-CellT và ADAM-CDx
Năm 2017, FDA đã phê duyệt thuốc tế bào CAR-T (tế bào T thụ thể kháng nguyên dạng khảm) có tác dụng tuyệt vời đối với bệnh ung thư máu. Khi nhu cầu về CAR-T tăng lên, nghiên cứu đã được phát triển vượt bậc. Độ chính xác và khả năng tái tạo cao đã trở nên quan trọng vì tổng số tế bào miễn dịch và khả năng sống đã trở thành các biến số chính.
Máy đếm tế bào tự động ADAM-MC2, ADAM-CellT (NanoEntek) và Neon* có thể sử dụng trong quy trình sản xuất CAR-T. Ngoài ra, ADAMII-CDx** là thiết bị toàn diện (all-in-one) cho phép quá trình sản xuất CAR-T có giá thiết bị và chi phí kiểm tra hợp lý khi so sánh với các thiết bị cạnh tranh khác trên thị trường. Một ưu điểm lớn là khi vận hành thiết bị không cần đào tạo hay các chuyên gia sử dụng, và giảm chi phí bảo trì vì các bộ xét nghiệm đều dùng một lần.
*Neon là nhãn hiệu đã đăng ký của Thermo Fisher Scientific.
NanoEntek độc quyền cung cấp hệ thống điện di (electroporator) cho Thermo Fisher Scientific dưới dạng sản phẩm ODM với tên là Neon.
**ADAM-CDx từ NanoEnTek hiện đang trong quá trình phát triển. Thiết bị này có thể được sử dụng như một giải pháp toàn diện trong quy trình sản xuất liệu pháp tế bào và R&D từ quá trình tách bạch cầu đến kiểm soát chất lượng sản phẩm.
Liệu pháp tế bào miễn dịch là gì?
Liệu pháp tế bào là quy trình kích thích tái tạo để phục hồi các tế bào bị tổn thương hoặc bị bệnh bằng cách sử dụng tế bào sống. Liệu pháp có thể được sử dụng để phát triển thuốc mới, thử nghiệm độc tính, đánh dấu sinh học, v.v. Liệu pháp tế bào có thể được chia thành ba phần: liệu pháp tế bào mô, liệu pháp tế bào miễn dịch và liệu pháp tế bào gốc. Chúng tôi sẽ tập trung cụ thể vào vấn đề mới nhất là liệu pháp tế bào miễn dịch.
Hình 1: Phân loại Y sinh học (Biomedicine)
Liệu pháp chính sử dụng trong điều trị ung thư: Sử dụng tế bào T đặc hiệu nhắm trúng mục tiêu tế bào mô ung thư
Y sinh học (Biomedicine) có thể được chia thành liệu pháp tế bào (Cell therapy) và liệu pháp gen (Gene therapy), và liệu pháp tế bào được chia nhỏ thành liệu pháp tế bào-mô (Tissue-cell therapy), liệu pháp tế bào miễn dịch (Immune cell therapy). Ngoài ra, liệu pháp gen có thể được chia thành liệu pháp gen tế bào miễn dịch (Immune cell gene therapy) và liệu pháp gen tế bào gốc (Stem cell gene therapy) [1].
Chúng ta sẽ tìm hiểu thêm chi tiết về liệu pháp tế bào – miễn dịch với CAR-T, cho thấy hiệu quả điều trị trong bệnh ung thư máu gần đây.
Định nghĩa tế bào CAR-T và ứng dụng
Liệu pháp tế bào (hay còn gọi là cellular therapy hoặc cytotherapy) là liệu pháp sử dụng vật liệu tế bào để tiêm, ghép hoặc cấy ghép vào bệnh nhân, thường là các tế bào sống nguyên vẹn. Ví dụ: tế bào T có khả năng chống lại các tế bào ung thư thông qua miễn dịch tế bào trung gian có thể được tiêm trong quá trình trị liệu miễn dịch.
Tế bào T thụ thể kháng nguyên dạng khảm (còn được biết với tên gọi tế bào CAR-T) là những tế bào T đã được chỉnh sửa gen để sản xuất thụ thể tế bào T nhân tạo. Tiền đề của liệu pháp miễn dịch CAR-T là các tế bào T thông qua chỉnh sửa nhận diện tế bào ung thư nhắm mục tiêu và tiêu diệt chúng hiệu quả hơn. Các nhà khoa học đã thu tế bào T từ người, chỉnh sửa gen và truyền tế bào T thu được vào bệnh nhân để tấn công khối u của họ. Tế bào CAR-T có thể có nguồn gốc từ tế bào T của bệnh nhân (autologous) hoặc từ tế bào T của người hiến khỏe mạnh (allogenic). Để tăng tính an toàn, tế bào CAR-T được thiết kế đặc hiệu đối với kháng nguyên biểu hiện trên khối u và kháng nguyên này không biểu hiện trên tế bào bình thường.
Hình 2: Nguồn gốc của tế bào CAR-T
Phân loại và chức năng của marker CD
Liệu pháp miễn dịch tế bào là phương pháp điều trị sử dụng tế bào miễn dịch (nhân tố chính chống lại ung thư), nuôi cấy, kích hoạt và cấy ghép để tấn công ung thư. Một trong những liệu pháp tế bào miễn dịch, CAR-T (tế bào T biểu hiện thụ thể kháng nguyên dạng khảm), được gọi là “Thuốc Sống” (Living Drug) vì chúng có khả năng giết chết tế bào khối u bằng chính tế bào T, tiếp tục phát triển và sống sau khi truyền vào cơ thể bệnh nhân [2].
Các nhóm các kháng nguyên bề mặt hoặc cụm biệt hóa (clusters of differentiation) thường được viết tắt là CD. CD là tên được đặt để định danh và nghiên cứu nhóm phân tử bề mặt tế bào dựa theo biểu hiện miễn dịch của chúng. [3]
Để cấy ghép liệu pháp tế bào miễn dịch thành công, số lượng tế bào dương tính với các cụm biệt hóa chính (CD) như tế bào T trưởng thành (CD3), tế bào T hỗ trợ (CD4), tế bào T độc hoặc tế bào T ức chế (CD8) là nhân tố quan trọng.
Tại sao nên lựa chọn NanoEntek?
Dòng máy đếm tế bào ADAM-MC ứng dụng trong trị liệu tế bào
Dòng máy đếm tế bào tự động ADAM-MC có thể sử dụng kiểm soát số lượng tế bào và khả năng sống trong quy trình sản xuất (tế bào CAR-T, tế bào gốc, v.v.) cho liệu pháp tế bào. Thêm vào đó, có thể sử dụng ADAM-MC2 dựa trên loại tế bào (máu toàn phần, PBMCs, v.v.) cần được theo dõi trong quá trình sản xuất sản phẩm cho liệu pháp tế bào.
Hình 3: Ứng dụng của ADAM-MC2
Hơn 100 trung tâm nghiên cứu liệu pháp tế bào và công ty trên toàn thế giới sử dụng máy đếm tế bào ADAM-MC và ADAM-MC2.
Hình 4. Các viện và công ty sử dụng sản phẩm của NanoEntek
So sánh các dòng máy đếm tế bào ADAM với kỹ thuật dòng chảy tế bào (Flow cytometry)
Khi nhu cầu toàn cầu về nghiên cứu và sản xuất liệu pháp tế bào ngày càng tăng lên, số lượng chính xác của tổng số tế bào và khả năng sống đã trở thành các nhân tố chính cũng như khả năng tái lập. Phương pháp truyền thống để phân tích số lượng tế bào là máy flow cytometry hay còn gọi là FACS (máy phân loại tế bào được kích hoạt bằng huỳnh quang - fluorescence-activated cell sorter). [4]
Hình 5. So sánh giữa sản phẩm của Nanoentek và FACS
Tuy nhiên, chi phí cho máy FACS đắt đỏ và cũng không thuận tiện về kích thước của thiết bị và các yếu tố ngẫu nhiên. Công việc quản lý trước và sau khi sử dụng cũng yêu cầu nhiều hóa chất, thời gian và công sức. Khi sử dụng điện trường cao để phân tách tế bào có nhược điểm là dễ gây hư hại tế bào và cần chuyên gia để vận hành cũng như quản lý thiết bị.
Hệ thống CAR-T của NanoEntek
Quá trình sản xuất CAR-T
Hình 6. Hệ thống CAR-T của NanoEntek
NanoEntek cung cấp nhiều loại máy đếm tế bào như ADAM-MC2, ADAM-CellT và Neon*. Các thiết bị có thể được sử dụng trong quy trình sản xuất từ bước tách bạch cầu cho đến kiểm soát chất lượng sản phẩm. Ngoài ra, Neon* là sản phẩm ODM được cung cấp độc quyền bởi NanoEntek cho Thermo Fisher và PerkinElmer.
Dễ dàng theo dõi tất cả các bước của quá trình tinh chế, tăng sinh và tạo công thức tế bào T bằng cách sử dụng các dòng máy ADAM-MC để đảm bảo kết quả chính xác và đáng tin cậy. ADAM-MC có thể dùng trong nghiên cứu phát triển, quá trình kiểm soát chất lượng tế bào CAR-T.
Sau khi lấy máu của bệnh nhân, quy trình sản xuất tế bào CAR-T phân lập tế bào T từ máu thông qua quá trình tách bạch cầu và kích hoạt tế bào T thông qua hạt phủ kháng thể Anti-CD3/ Anti-CD28.
Sau đó, CAR-T được tạo ra từ biểu hiện của gen CAR bằng cách thực hiện chuyển gen, và gen CAR chuyển vào tế bào T đã hoạt hóa. Trước khi truyền trở lại vào bệnh nhân, số lượng tế bào CAR-T được tăng lên thông qua bước nuôi cấy, thu hoạch và lưu trữ. [5]
*Neon là nhãn hiệu đã đăng ký của Thermo Fisher Scientific.
NanoEnTek cung cấp độc quyền cho ODM máy điện di electroporator để truyền vật liệu di truyền vào tế bào với hiệu suất cao với ba bằng sáng chế.
Sản phẩm sáng tạo mới của NanoEntek, ADAMⅡ-CDx (sắp ra mắt)
Hình 7: Ứng dụng của ADAMⅡ-CDx
ADAM-CDx của NanoEntek hiện đang trong quá trình phát triển. Thiết bị này có thể được sử dụng như một giải pháp toàn diện trong quy trình nghiên cứu phát triển và sản xuất liệu pháp tế bào từ quá trình tách bạch cầu đến kiểm soát chất lượng sản phẩm.
ADAM-CDx chuyên dùng cho nhiều loại tế bào khác nhau như tế bào T, tế bào B và tế bào NK để xác định các loại tế bào và sử dụng các chức năng khác nhau như đếm tổng số tế bào, kích thước tế bào và chu kỳ tế bào.
CÁC NGHIÊN CỨU SỬ DỤNG ADAM-MC2
[1] Hybrid SMART spheroids to enhance stem cell therapy for CNS injuries. Science advances, 7(40), eabj2281.
Link: https://doi.org/10.1126/sciadv.abj2281
[2] Plasma complement C7 as a target in non-small cell lung cancer patients to implement 3P medicine strategies. EPMA Journal, 629-645.
Link: https://doi.org/10.1007/s13167-021-00266-x
[3] Adoptive immunotherapy with transient anti-CD4 treatment enhances anti-tumor response by increasing IL-18Rαhi CD8+ T cell, Nature
Communications, 12(1), 1-15, 2021
Link: https://doi.org/10.1038/s41467-021-25559-7
[4] IL7-Fc Enhances the Efficacy of Adoptive T Cell Therapy under Lymphopenic Conditions in a Murine Melanoma Model. Cells 2021, 10, 2018.
Link: https://doi.org/10.3390/cells10082018
[5] TDP-43 and PINK1 mediate CHCHD10 S59L mutation–induced defects in Drosophila and in vitro. Nature Communications, March, 2021.
Link: https://doi.org/10.1038/s41467-021-22145-9
[6] Polymorphic Region-Specific Antibody for Evaluation of Affinity-Associated Profile of Chimeric Antigen Receptor, Molecular Therapy
Oncolytics, 17, pp. 293-305, 2020.
Link: https://www.sciencedirect.com/science/article/pii/S2372770520300541
[7] Chronic activation of 4-1BB signaling induces granuloma development in tumor-draining lymph nodes that is detrimental to subsequent CD8+
T cell responses, Cellular & Molecular Immunology, August 2020.
Link: https://doi.org/10.1038/s41423-020-00533-3
CÁC NGHIÊN CỨU SỬ DỤNG ADAM-CELLT
[1] Single-Cell Analyses Identify Brain Mural Cells Expressing CD19 as Potential Off-Tumor Targets for CAR-T Immunotherapies, Cell, 183 (1),
pp. 126-142.e17, October, 01, 2020.
Link: https://doi.org/10.1016/j.cell.2020.08.022
[2] Expression of the transcription factor PU.1 induces the generation of microglia-like cells in human cortical organoids, Nature Communications, 13, 430, 2022
Link: https://doi.org/10.1038/s41467-022-28043-y
[3] Heterozygous frameshift variants in HNRNPA2B1 cause early-onset oculopharyngeal muscular dystrophy, Nature Communications, 13, 2306, 2022
Link: https://doi.org/10.1038/s41467-022-30015-1
Nguồn tham khảo
[1] Future of Cell Therapy in the Regenerative Medicine Market(2016), Frost&Sullivan, 나노엔텍 재가공
[2] Viardot, Andreas, et al. "Chimeric antigen receptor(CAR) T-cell therapy as a treatment option for patients with B-cell lymphomas: perspectives on the therapeutic potential of Axicabtagene ciloleucel." Cancer management and research 11(2019): 2393
[3] CHAN, J. K. C., NG, C. S., HUI, P. K.(1988). “A simple guide to the terminology and application of leucocyte monoclonal antibodies”. 《Histopathology》 12(5): 461–480.
[4] Huh, D.; WeiGu; Kamotani, Y.; Grotberg, J. B.; Takayama, S.Physiologicla Measurement 2005, 26, R73-R98.
[5] 채희정, and 윤덕현. "광범위큰 B 세포림프종에 대한 키메릭항원수용체 T-세포(Chimeric Antigen Receptor T-cells) 치료." Korean Journal of Medicine(구 대한내과학회지) 94.2(2019): 152-158.