Chất Bảo Quản Lạnh DMSO Trong Các Sản Phẩm Trị Liệu Tế Bào
Sản Phẩm & Công Nghệ Mới
Chất Bảo Quản Lạnh DMSO Trong Các Sản Phẩm Trị Liệu Tế Bào
DMSO là chất bảo quản tế bào được sử dụng phổ biến trong bảo quản lạnh các sản phẩm trị liệu tế bào ở hàm lượng 10%. Thông thường không bắt buộc phải rửa (loại bỏ DMSO) các sản phẩm tế bào đã rã đông, vì làm như vậy có thể làm mất tế bào ngoài ý muốn.
Một số vấn thường được đặt ra bởi các trung tâm ghép tế bào gốc/ trị liệu tế bào như sau:
- Tỷ lệ DMSO dùng trong bảo quản lạnh tế bào gốc là bao nhiêu?
- Có cần phải rửa (loại bỏ) chất bảo quản tế bào (DMSO) trước khi ghép?
- Nếu không rửa, tỷ lệ chất bảo quản tế bào trong đơn bị tế bào gốc là bao nhiêu sẽ được chấp nhận? theo tài liệu khuyến nghị/ hướng dẫn của cơ quan quốc tế nào?
- Nếu phải rửa, quy trình loại bỏ chất bảo quản tế bào (DMSO) được thực hiện như thế nào?
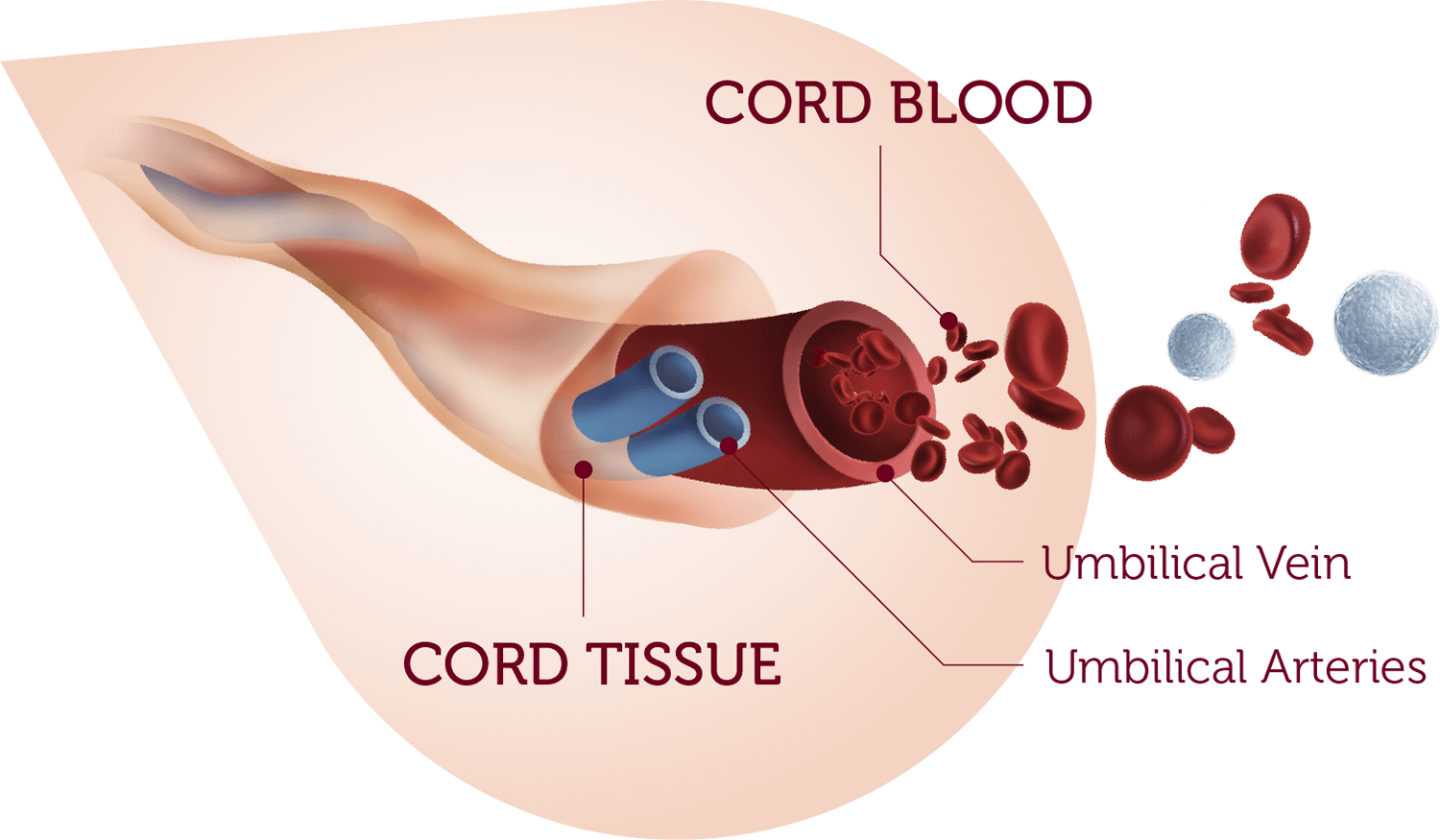
Thu thập, xử lý, lưu trữ các chế phẩm tế bào tiền thân tạo máu từ máu dây rốn (HPC-CB)
Các chế phẩm HPC-CB (tế bào tiền thân tạo máu từ máu dây rốn) được thu thập như một nguồn HPCs từ dây rốn ở giai đoạn thứ ba của chuyển dạ hoặc từ nhau thai sau khi sinh. Sau khi làm sạch dây rốn, máu được thu thập bằng cách dẫn lưu trọng lực vào các túi thu thập chuẩn có chứa chất chống đông máu. Trước khi bảo quản lạnh, việc thu thập máu cuống rốn thường được xử lý bằng cách loại bỏ hồng cầu và huyết tương. Các sản phẩm HPC-CB thường được bảo quản với chất bảo quản lạnh DMSO 10% cuối cùng trong các túi bảo quản lạnh được thiết kế nhiều ngăn (phổ biến là 2 ngăn) để dễ dàng sử dụng và kiểm tra hiệu lực và nhận dạng (for identity and potency testing). Các sản phẩm máu cuống rốn đông lạnh được vận chuyển đến trung tâm cấy ghép trước khi bắt đầu điều trị bệnh nhân và thường được rã đông bằng phương pháp rửa hoặc hoàn nguyên trước khi truyền. Trường hợp, các sản phẩm HPC-CB không bị giảm hồng cầu nên được rửa hoặc pha loãng để giảm bớt tác dụng tiềm tàng của quá trình tán huyết.
Độc tính và các biến chứng có thể gây ra bởi chất bảo quản tế bào DMSO
Bảo quản đông lạnh là quá trình ổn định vật liệu sinh học ở nhiệt đô cực thấp.
Bảo quản tế bào là quy trình sinh học nhằm đảm bảo tính ổn định về mặt di truyền và cấu trúc nguyên vẹn của các tế bào sống, đảm bảo các thành phần như nucleic acid và protein của tế bào không thay đổi trong quá trình bảo quản lạnh.
Các sản phẩm HPC-BC được bảo quản đông lạnh có thể được lưu trữ lâu dài theo hướng dẫn của nhà sản xuất hoặc theo phương pháp đã được xác thực. Các sản phẩm này có thể được rã đông tại phòng thí nghiệm xử lý tế bào, hoặc rã đông tại giường bệnh ngay trước khi sử dụng. Các sản phẩm này nên được truyền càng sớm càng tốt sau khi quá trình rã đông xảy ra.
DMSO là chất bảo quản lạnh tế bào được sử dụng phổ biến trong bảo quản lạnh các sản phẩm trị liệu tế bào. Độc tính DMSO là biến chứng phổ biến nhất của việc quản lý sản phẩm bảo quản lạnh. Các tác dụng phụ của DMSO và các triệu chứng thường liên quan đến việc giải phóng histamine.
Các dấu hiệu và triệu chứng của tác dụng phụ gây ra bởi DMSO
- Cảm giác bỏng rát, đỏ bừng và / hoặc phát ban.
- Tim mạch không ổn định và / hoặc tức ngực
- Khó thở, thở khò khè và / hoặc ho
- Nhức đầu, bị co giật
- Buồn nôn, nôn và / hoặc chứng hôi miệng
Điều trị
- Dùng thuốc kháng histamine và steroid.
- Làm chậm tốc độ truyền
- Chăm sóc hỗ trợ bệnh nhân.
Phòng ngừa
- Liệu pháp kháng histamine dự phòng.
- Cung cấp kẹo cứng để tránh buồn nôn do mùi và / hoặc vị.
- Loại bỏ DMSO khỏi sản phẩm bằng cách rửa sạch tế bào trước khi dùng cho người nhận bị bệnh thận và tim đáng kể có thể làm giảm nguy cơ xuất hiện các triệu chứng. Thông thường không bắt buộc phải rửa mọi sản phẩm tế bào đã rã đông vì làm như vậy có thể làm mất tế bào ngoài ý muốn. Đối với các đơn vị máu cuống rốn không xử lý bỏ hồng cầu (RBC) trước khi bảo quản lạnh nên được rửa trước khi truyền cho người nhận.
- Nếu sản phẩm rã đông chưa được rửa để loại bỏ DMSO, cần lưu ý không vượt quá 1 mL DMSO trên mỗi kg trọng lượng người nhận mỗi ngày sử dụng (ví dụ: 100 mL dung dịch 10% chứa 10 mL DMSO).
(Nguồn: Circular of Information for the Use of Cellular Therapy Products – AABB 2021)








.png)